- Accueil
- Actualités
- Les Réseaux D’actine En Super Résolution
Les réseaux d’actine en super résolution
Le Laboratoire d’optique et biosciences (LOB) de l’École polytechnique a participé à une étude coordonnée par l’Institut de Biologie Paris-Seine et qui vient de paraître dans Nature, sur la découverte d’un mécanisme cellulaire essentiel au développement embryonnaire.
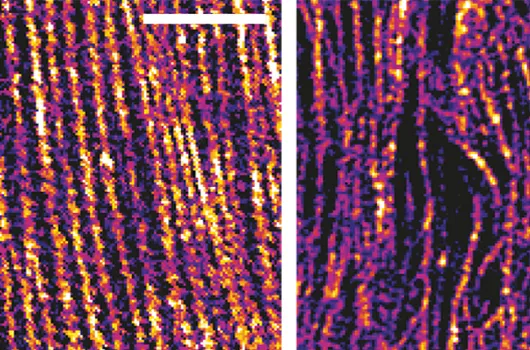
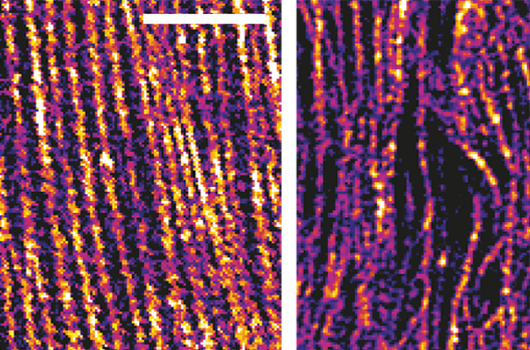
Le ver Caenorhabditis elegans (C. elegans) est un organisme modèle particulièrement intéressant pour étudier la morphogénèse, l'ensemble des lois qui déterminent la forme, la structure des tissus, des organes et des organismes.
Lors de son développement embryonnaire, C. elegans s’étire pour devenir deux fois plus long sous l’effet de contractions musculaires qui déforment son épiderme. Cette méthode est tout à fait contre-intuitive car après s’être contracté, un muscle reprend habituellement sa forme initiale sans s’être allongé.
Les chercheurs du Laboratoire de biologie du développement de l’Institut de Biologie Paris-Seine (IBPS, CNRS/Sorbonne Université) ont déduit de ce comportement qu’il devait exister un mécanisme permettant de bloquer transitoirement la forme de l’embryon après chaque contraction musculaire.
Pour vérifier cette hypothèse, ils ont développé une démarche expérimentale pluridisciplinaire alliant génétique, biologie cellulaire et physique.
Ce travail a permis d’identifier la nature moléculaire de la machinerie de blocage de la forme. Partant d’une protéine kinase connue pour réguler certaines propriétés mécaniques des cellules, les chercheurs ont pu identifier un nouveau partenaire, une protéine constitutive du squelette de la cellule, l’alpha spectrine. Ils ont montré que l’absence conjointe de ces deux facteurs conduisait l’embryon de C. elegans à se rétracter après les contractions musculaires.
Grâce à des approches génétiques et à l’imagerie à haute résolution in vivo menée au LOB, ils ont établi que ces deux protéines orchestraient la réorganisation du squelette d’actine (réseau intracellulaire conférant rigidité et élasticité à la cellule) de l’épiderme à l’aide de protéines capables de couper puis de peigner les filament d’actine.
Les images en imagerie optique super-résolue obtenues grâce à un des systèmes de la plateforme Morphoscope ont permis de mettre en évidence les différences de microstructure entre un cytosquelette en bon état et un cytosquelette désorganisé, où les filaments d’actine ne sont plus parallèles.
Les données suggèrent que ces protéines contrôlant la réorganisation du réseau d’actine permettent de bloquer la forme des cellules selon un processus apparenté à un mécanisme à cliquet et soulignent l’importance de la plasticité dans la modification de la forme des cellules.
Ces découvertes pourraient avoir des implications sur notre compréhension de la morphogénèse des organes en contact avec un épithélium, les processus de cicatrisation après blessure, ou la compréhension du caractère invasif des cellules tumorales. L’organisation de nos organes avec des cellules contractiles apposées à des cellules épithéliales fait que ces dernières sont très régulièrement soumises à des forces mécaniques qui peuvent en modifier la forme, le comportement ou la fonction. Plusieurs maladies, dont certaines formes de cancer, sont dues à une mauvaise réponse au stress mécanique.
Pour en savoir plus : An actin-based viscoplastic lock ensures progressive body axis elongation
Alicia Lardennois, Gabriella Pásti, Teresa Ferraro, Flora Llense, Pierre Mahou, Julien Pontabry, David Rodriguez, Samantha Kim, Shoichiro Ono, Emmanuel Beaurepaire, Christelle Gally, Michel Labouesse
Nature, 28 août 2019
Retour à la liste