Organisation du collagène tissulaire à l'échelle nanométrique : mesurer sans voir
La calibration de la réponse optique non-linéaire des structures collagéniques a permis d'accéder à la mesure de leurs dimensions à l'échelle nanométrique. L'application de cette approche à des tissus intacts constitue une étape majeure vers une nouvelle technique d'imagerie non invasive.
Le collagène est une protéine jouant le rôle de brique élémentaire dans la construction et l'architecture de nombreux tissus. Un nombre important de pathologies observées lors du développement, de la cicatrisation ou associées au cancer produisent des défauts dans cette architecture. Si les techniques optiques récentes permettent d'étudier l'organisation du collagène dans des tissus intacts et sans marquage, elles ne pouvaient jusqu'à maintenant mesurer la taille des assemblages élémentaires du collagène (fibrilles), inférieure à la résolution optique.
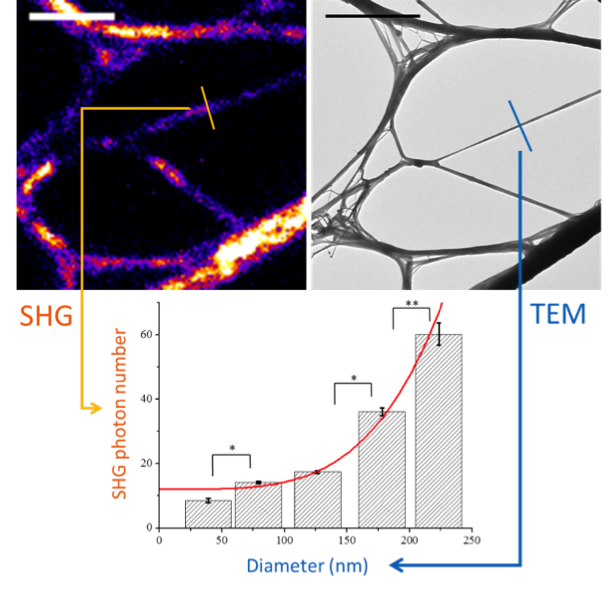
Pour contourner cette limite, nous avons préparé des fibrilles de collagène de taille variant de 30 à 250 nm. Ces fibrilles ont été étudiées par imagerie de génération de second harmonique (SHG, correspondant à la génération d'un signal lumineux de fréquence double de la lumière incidente) et par microscopie électronique à transmission. Il a ainsi été possible d'effectuer une calibration du signal SHG en fonction de la taille des fibrilles. Cette calibration a été confrontée à des calculs analytiques et numériques, démontrant que l'excellente sensibilité de cette technique est liée à l'alignement parallèle des molécules de collagène au sein d'une fibrille dont les signaux individuels interfèrent ainsi de manière constructive. Elle a ensuite été appliquée avec succès à l'étude d'une cornée de rat diabétique intact présentant des anomalies structurelles dans sa partie postérieure.
Si cette approche est très bien adaptée à l'étude de fibrilles isolées, son extension à des tissus denses, comme la peau, va nécessiter des mesures complémentaires sensibles à l'organisation des fibrilles. Le développement parallèle de microscopes et endoscopes multiphotons laisse espérer un prochain transfert de notre approche quantitative vers l'imagerie médicale in vivo.
Ce travail est le fruit d'une collaboration entre S. Bancelin, I. Gusachenko, G. Latour et M.-C. Schanne-Klein du laboratoire d'Optique et Biosciences (UMR 7645 CNRS / INSERM U696 /Ecole Polytechnique), C. Aimé et T. Coradin de l'équipe « Matériaux et Biologie » du laboratoire de Chimie de la Matière Condensée de Paris (UMR 7574, UPMC/CNRS/Collège de France) et L. Kowalczuk de l'équipe 17 du Centre de Recherche des Cordelier (INSERM UMRS 872 / UPMC).
Référence :
S. Bancelin, C. Aimé, I. Gusachenko, L. Kowalczuk, G. Latour, T. Coradin, and M.-C. Schanne-Klein, Determination of collagen fibril size via absolute measurements of second-harmonic generation signals, Nat. Commun. 5:4920, doi : 10.1038/ncomms5920 (2014).
http://www.nature.com/ncomms/2014/140916/ncomms5920/full/ncomms5920.html
Calibration of collagen second-harmonic (SHG) signal at fibrillar scale via implementation of correlative SHG-electron imaging
We report absolute measurements of second-harmonic (SHG) signals from isolated unstained collagen fibrils down to 30_nm diameter, via correlation to electron microscopy. We show that the high sensitivity of this optical technique originates from the parallel alignment of collagen triple helices within fibrils and the subsequent constructive interferences of second-harmonic radiations. This calibration is subsequently used to determine the size of isolated hyperglycemia-induced collagen fibrils in the Descemet's membrane of a rat cornea. Altogether, those results represent a major step towards in situ quantification of collagen fibrils in intact tissues, which is a crucial issue to investigate pathological disorders associated with structural defects of the extracellular matrix.
S. Bancelin, C. Aimé, I. Gusachenko, L. Kowalczuk, G. Latour, T. Coradin, and M.-C. Schanne-Klein, Determination of collagen fibril size via absolute measurements of second-harmonic generation signals, Nat. Commun. 5:4920, doi : 10.1038/ncomms5920 (2014).
http://www.nature.com/ncomms/2014/140916/ncomms5920/full/ncomms5920.html
